L'état quantique n, l, m, s
-
Le nombre principal n prend des valeurs entières et correspond au numéro de la couche. Il détermine donc le numéro de la couche quantique à laquelle appartient l'électron.
-
Le nombre secondaire l peut prendre toutes les valeurs comprises entre 0 et n-1. Il détermine la sous-couche correspondante. Les sous-couches sont désignées par des lettres : s, p, d, f (pour croissant depuis 0).
-
Le nombre magnétique m peut prendre toutes les valeurs comprises entre - et . Il détermine le moment orbital de l'électron.
-
Le nombre de spin s ne peut prendre que les valeurs 1/2 et -1/2 et détermine la valeur du moment de Spin de l'électron.
Les régles de remplissage
De manière générale, les électrons occupent les états de plus basse énergie disponibles et commencent par remplir les couches de numéros n les plus faibles et à l'intérieur d'une couche les sous-couches dans l'ordre croissant soit s, p, d... Malheureusement, les choses se gâtent à partir de la couche n° 3 dont des sous-couches présentent des niveaux d'énergie moindres que certaines sous-couches de la couche n°2 : on applique alors la règle de Klechkowski qui stipule que on remplit d'abord les sous-couches présentant le nombre n+ le plus faible avec, pour départager, n le plus petit possible (on note cependant quelques exceptions à cette règle comme Cr ou Cu ).
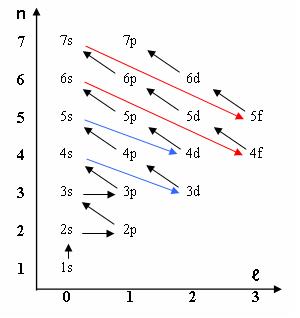
Figure 1 : Illustration de la règle de Klechkowski
Propriétés magnétiques de l'atome à l'état libre
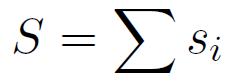
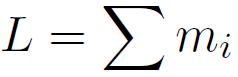
Le moment magnétique absolu de l'atome a pour amplitude :
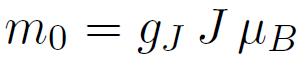
Où µB=9,273.10-24 Am2 désigne le magnéton de Bohr et gj le facteur de Landé :
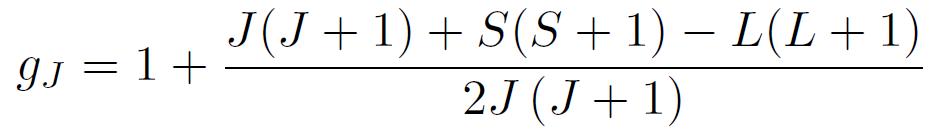
Les configurations électroniques les plus stables sont déterminées par les règles de Hund. Celles-ci stipulent que :
- La répartition maximise le moment de Spin, en accord avec le principe d'exclusion de Pauli.
- La répartition maximise le moments orbital, en accord avec le principe d'exclusion de Pauli et la première règle de Hund.
- Pour une couche plus qu'à moitié pleine, on a J=L+S, alors que pour une couche moins qu'à moitié pleine, on a J=|L-S|.
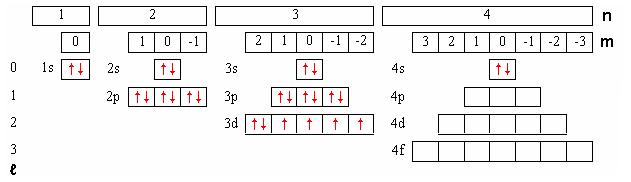
Figure 2 : Représentation des cases quantiques associées aux différentes sous-couches et exemple de remplissage pour l'atome de Fer (Z=26). L'orientation des flèches indique la valeur du nombre de spin (± ?). Conformément à la règle d'exclusion de Pauli, une case quantique ne peut être occupé que par deux électrons au maximum, qui doivent présenter des spins opposés. Le remplissage de la sous-couche incomplète 3d obéit aux règles de Hund. On obtient alors la structure électronique 1s2 2s2 2p6 3s2 3p6 4s2 3d6 et les nombres quantiques caractéristiques des propriétés magnétiques de l'atome à l'état libre S=2 L=2 J=4


